Decomposição térmica do nitrato de potássio
Resolução comentada de exercício sobre termoquímica envolvendo a decomposição térmica do nitrato de potássio. Foi pedido para escrever a equação química da reação e descobrir se o processo é endotérmico ou exotérmico.
Decomposição térmica do nitrato de potássio
Enunciado
(UNICAMP) Explosão e incêndio se combinaram no terminal marítimo de São Francisco do Sul, em Santa Catarina, espalhando muita fumaça pela cidade e pela região. O incidente ocorreu com uma carga de fertilizante em que se estima tenham sido decompostas 10 mil toneladas de nitrato de amônio. A fumaça branca que foi eliminada durante 4 dias era de composição complexa, mas apresentava principalmente os produtos da decomposição térmica do nitrato de amônio: monóxido de dinitrogênio e água. Em abril de 2013, um acidente semelhante ocorreu em West, Estados Unidos da América, envolvendo a mesma substância. Infelizmente, naquele caso, houve uma explosão, ocasionando a morte de muitas pessoas.
a) Com base nessas informações, escreva a equação química da decomposição térmica que ocorreu com o nitrato de amônio.
b) Dado que os valores das energias padrão de formação em kJ mol–1 das substâncias envolvidas são nitrato de amônio (-366), monóxido de dinitrogênio (82) e água (-242), o processo de decomposição ocorrido no incidente é endotérmico ou exotérmico? Justifique sua resposta considerando a decomposição em condições padrão.
Resolução
a) Primeiramente, sempre escreva a equação da reação, mesmo quando não for pedido, pois essa etapa é muito importante e facilita a resolução dos exercícios. Então, tente fazer disso um hábito.
Sendo assim, vamos escrever a equação química da decomposição térmica no nitrato de amônio. O procedimento é simples, basta colocar os reagentes do lado esquerdo e os produtos do lado direito da seta. Nossa tarefa nesse exercício está ainda mais fácil, pois nos foi dado a informação dos produtos gerados nesta reação. Então, veja abaixo como fica.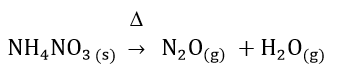
Para indicarmos a presença de calor na reação colocamos a letra grega delta acima da seta.
Muita atenção agora, pois sempre devemos conferir se a equação está balanceada. Note que no lado dos reagentes temos 3 átomos de oxigênio e 4 de hidrogênio. Já no lado dos produtos temos 2 átomos de oxigênio e 2 de hidrogênio. Portanto, a equação não está balanceada.
Para resolver isso basta adicionarmos o 2 na molécula de água e então a equação ficará balanceada. Veja como fica abaixo. 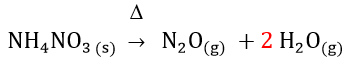
Decomposição térmica do nitrato de potássio
b) Para resolver o item b, devemos lembrar da lei de Hess, a qual pode ser enunciada da seguinte forma: “a entalpia de uma reação é a diferença entre o somatório das entalpias de formação de seus produtos e o somatório das entalpias de formação de seus reagentes nas mesmas condições de temperatura e pressão.”
Portanto, podemos expressar a lei de Hess numericamente como mostrado abaixo. 
Lembrando que o símbolo H (entalpia) indica a energia padrão de formação das substâncias.
Agora, vamos facilitar nossa resolução e indicar os valores de energia padrão de formação das substâncias na equação. Note que esses valores foram informados no enunciado.
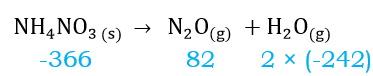
Por último, precisamos apenas substitur os valores na fómula da lei de Hess, como mostrado abaixo.
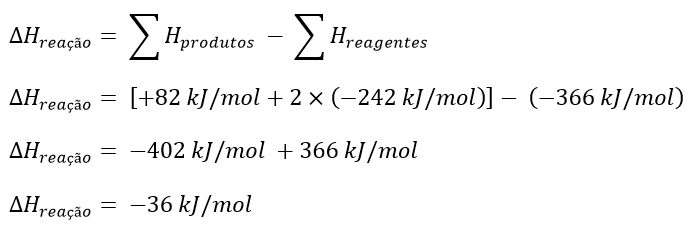
O sinal negativo indica que a reação é exotérmica, ou seja ocorre a liberação de energia.



