Um cilindro fechado, dotado de um êmbolo que…
(Química 2, Martha Reis) Um cilindro fechado, dotado de um êmbolo que pode se deslocar sem atrito, contém inicialmente gás nitrogênio ocupando um volume igual a 180 cm3, sob pressão de 150.000 Pa, a 27 °C.
a) A que temperatura em °C o gás deve ser levado para que seu volume se reduza para 120 cm3, mantendo-se a pressão constante?
b) Esboce o gráfico dessa transformação.
Resolução
De acordo com a primeira lei de Charles e Gay-Lussac, uma determinada quantidade de gás em um sistema fechado a pressão constante, ocupa um volume que é diretamente proporcional à sua temperatura absoluta. Dessa forma, utilizando a fórmula a seguir, é possível prever o resultado da mudança no volume ou na temperatura de uma gás nessas condições.
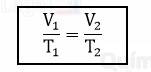
Mas antes, devemos converter a tempartura, em °C, para temperatura absoluta, ou seja, em Kelvin. Para isso, basta somar 273 ao valor atribuído na escala Celsius. Logo:

Então, substituindo os valores na fórmula temos:

Por fim, basta transformar a temperatura absoluta para a escala Celsius.

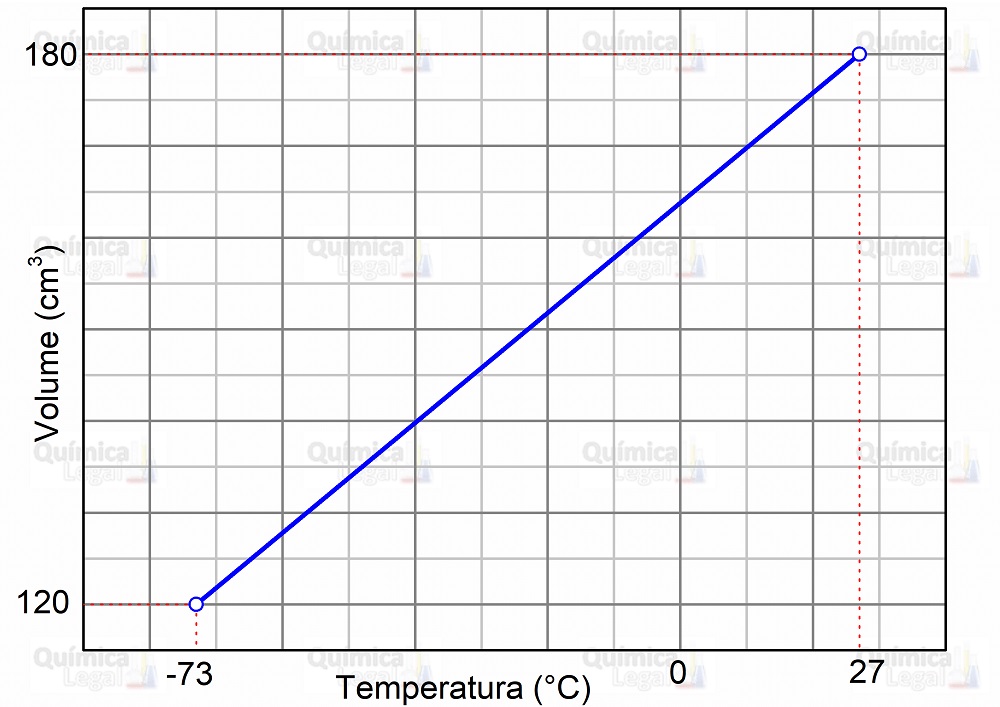
b) Para esboçar o gráfico, basta colocar os valores da temperatura na abscissa (eixo x) e os valores do volume na ordenada (eixo y), conforme mostrado na figura a seguir.
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTUDO DOS GASES.
Gostaria de ver mais LIVROS RESOLVIDOS DE QUÍMICA?


