Uma solução aquosa de ácido clorídrico concentrado…
(Técnico de Laboratório / Área: Química (UFG 2015)) Uma solução aquosa de ácido clorídrico concentrado (HCℓ; Massa molar = 36,5 g/mol) possui teor de HCℓ igual a 36,5% (m/m) e densidade igual a 1,19 g/mL. Um técnico de laboratório necessita preparar 500 mL de solução de HCℓ com concentração 0,50 mol/L. O volume a ser medido da solução concentrada, em mL, para preparar a referida solução será:
a) 7,67.
b) 15,34.
c) 21,01.
d) 42,02.
Resolução
A concentração e o volume da solução a ser preparada foram informados no enunciado. Assim, podemos calcular o número de mols de HCℓ.
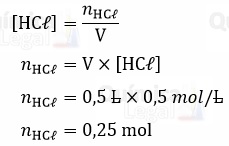
Sabemos que o número de mols (n) é igual a razão entre a massa (m) e massa molar (MM). Logo, temos:
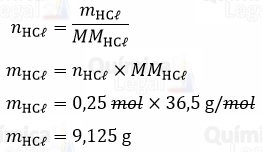
Então, para descobrir a massa da solução concentrada necessária para obtermos 9,125 gramas de HCl, podemos utilizar a porcentagem em massa (τ%) informada no enunciado.

Por fim, basta utilizar a densidade informada no enunciado.

Gabarito: LETRA C
Confira mais EXERCÍCIOS RESOLVIDOS sobre SOLUÇÕES.
Veja as resoluções de todas as questão da prova: Técnico de Laboratório / Área: Química (UFG 2015).
Tá afim de ver mais PROVAS RESOLVIDAS dos concursos organizados pelo Centro de Seleção UFG?



