A energia interna de um sistema aumentou 982 J quando ele…
(Princípios de Química, Atkins) A energia interna de um sistema aumentou 982 J quando ele absorveu 492 J de calor.
a) O trabalho foi realizado contra ou a favor do sistema?
b) Quanto trabalho foi realizado?
Resolução
a) Segundo a Primeira Lei da Termodinâmica, apresentada na sequência, a variação de energia interna (ΔU) em um sistema fechado é resultado da transferência de energia na forma de calor (q) e trabalho (W).

De acordo com o enunciado, a variação da energia interna do sistema é maior do que o calor e ambos são valores positivos. Assim, o trabalho, calculado subtraindo o calor da variação da energia interna, também é positivo.
Por convenção, o trabalho é positivo sempre que for realizado sobre o sistema, ou seja, realizado contra o sistema. Como exemplo o trabalho realizado pela compressão de um gás por um pistão.
b) O valor do trabalho pode ser calculado utilizando a fórmula da Primeira Lei da Termodinâmica e os valores de ΔU e q fornecidos no enunciado, conforme demonstrado a seguir:
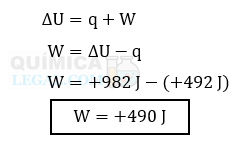
Portanto, foi realizado um trabalho de 490 J sobre o sistema.



