As variações de entalpia (∆H) do oxigênio, do estanho…
(Unicamp-SP) As variações de entalpia (∆H) do oxigênio, do estanho e dos seus óxidos, a 298 K e 1 bar, estão representadas no diagrama abaixo.
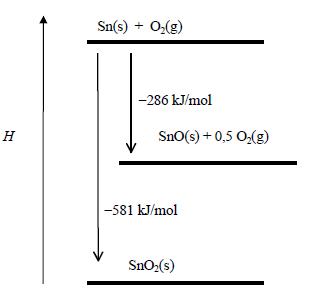
Assim, a formação do SnO(s), a partir dos elementos, corresponde a uma variação de entalpia de –286 kJ/mol.
a) Calcule a variação de entalpia, ∆H1, correspondente à decomposição do SnO2(s) nos respectivos elementos, a 298 K e 1 bar.
b) Escreva a equação química e calcule a respectiva variação de entalpia, ∆H2, da reação entre o óxido de estanho II e o oxigênio, produzindo o óxido de estanho IV, a 298 K e 1 bar.
Resolução
a) Segundo o gráfico, a variação de entalpia para a reação de formação do SnO2 a partir de Sn(s) e O2(g) é igual a −581 kJ/mol. Dessa forma, a variação de entalpia para a reação de decomposição do SnO2, representada abaixo, é igual a +581 kJ/mol.
SnO2(s) → Sn(s) + O2(g)
b) Reação de produção do óxido de estanho IV a partir do óxido de estanho II e oxigênio:
SnO(s) + ½ O2(g) → SnO2(s)
Observe pelo gráfico que a entalpia dos produtos e dos reagentes para esta reação é igual a −581 kJ/mol e −286 kJ/mol, respectivamente. Portanto, a variação de entalpia da reação é dada por:
∆H = HPRODUTOS − HREAGENTES
∆H = −581 kJ/mol – (−286 kJ/mol)
∆H = −581 kJ/mol + 286 kJ/mol
∆H = −295 kJ/mol
Confira mais EXERCÍCIOS RESOLVIDOS sobre TERMOQUÍMICA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da Unicamp?



