Estrutura de Lewis para um átomo de Cloro
(Mackenzie-SP) A espécie química representada por:
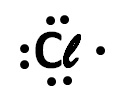
a) é um ânion.
b) é um cátion.
c) é uma molécula completa.
d) pode ligar-se tanto a metais como a não-metais.
e) é um átomo que apresenta camada de valência completa.
Resolução
A imagem apresentada no enunciado é a representação da estrutura de Lewis para um átomo de Cloro. Pois, a estrutura de Lewis sempre irá representar os elétrons da camada de valência de um determinado átomo.
Diante disso, vamos fazer a distribuição eletrônica dos elétrons do átomo de Cloro. Esse elemento químico possui número atômico igual a 17. Portanto, possui 17 prótons no seu núcleo, e, consequentemente têm 17 elétrons. Pois, em um átomo neutro o número de cargas positivas (prótons) é igual ao número de cargas negativas (elétrons).
(K) 1s2
(L) 2s2 2p6
(M) 3s2 3p5
Repare que em vermelho temos a camada de valência e nela há 7 elétrons.
Agora vamos analisar e julgar as informações apresentadas em cada alternativa.
Estrutura de Lewis para um átomo de Cloro
(a) Um ânion é uma espécie com excesso de carga negativa, ou seja, uma espécie que recebeu um ou mais elétrons. Assim, podemos dizer que a alternativa é falsa, pois a espécie apresentada é um átomo neutro de Cloro, ou seja, no estado fundamental.
(b) Um cátion, ao contrário de um ânion, é uma espécie com excesso de carga positiva. Como os prótons não podem ser movidos do núcleo, para uma espécie se tornar um cátion ela deve perder um ou mais elétrons. Portanto, essa alternativa também está incorreta, uma vez que a espécie apresentada é um átomo de cloro no estado fundamental.
(c) Uma molécula é uma espécie formada pela ligação de dois ou mais átomos. Dessa forma, essa alternativa incorreta, pois a espécie em questão se trata apenas de um átomo de Cloro.
(d) Os Cloro estão no grupo 17 da tabela periódica, grupo esse que também é conhecido como halogênios. Elementos deste grupo apresentam a tendência de receber um elétron, logo, eles formam ligações iônica com o átomo do elemento químico que doou o elétron. Além disso, os halogênios podem compartilhar os elétrons com outros átomos de outros elementos químicos que apresentam tendência de receber elétrons, formando assim ligações covalente. Portanto, essa é alternativa contendo a informação correta.
(e) De acordo com a regra do octeto, um átomo precisar ter 8 elétrons na camada de valência para que ele fique completa. Lembrando que o hidrogênio e o hélio atingem a camada completa com dois elétrons. Assim, a informação contida nessa alternativa está incorreta.
Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS sobre LIGAÇÕES QUÍMICAS.
Tá afim de ver mais RESOLUÇÕES COMENTADAS do Mackenzie?


