O buckminsterfulereno é uma forma alotrópica do…
(UFAM) O buckminsterfulereno é uma forma alotrópica do carbono e possui fórmula molecular igual a C60. Considere que 2,16 g de C60 foram completamente queimados na presença de oxigênio em excesso, a uma pressão de 1,0 atm. Qual o volume de dióxido de carbono produzido, caso o sistema mantenha a temperatura constante e igual a 27 °C?
a) 1.344 L
b) 2,24 L
c) 8,8 L
d) 60 L
e) 4,4 L
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
Reação de combustão do C60:
C60(s) + 60 O2(g) → 60 CO2(g)
De acordo com a equação química balanceada, a queima de 1 mol de C60 produz 60 mols de CO2. Assim, temos:

Então, para calcular o volume de 0,003 mol de CO2, podemos utilizar a equação de Clapeyron, como mostrado abaixo:
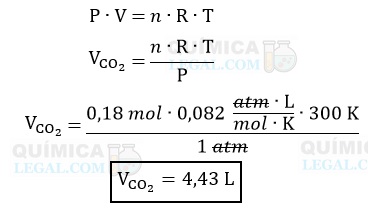
Lembre-se de que: TK = TºC + 273
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da UFAM?


