O clorato de potássio (KCℓO3) pode ser utilizado para a produção…
(Unesp-SP) O clorato de potássio (KCℓO3) pode ser utilizado para a produção de oxigênio em laboratório. Quando aquecido na presença de um catalisador, o clorato se decompõe produzindo, além do gás desejado, cloreto de potássio (KCℓ). O volume de oxigênio medido nas CNTP (T = 273 K e P = 1 atm, com R = 0,082 L∙atm / K∙mol) produzido quando um mol do clorato é consumido é de:
a) 67,2 L.
b) 56,0 L.
c) 44,8 L.
d) 39,2 L.
e) 33,6 L.
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
A decomposição do clorato de potássio para produzir oxigênio pode ser representada pela seguinte equação química balanceada:
2 KCℓO3(s) → 3 O2(g) + 2 KCℓ(s)
É importante observar que a equação acima está balanceada, o que assegura que o número de átomos de cada elemento químico seja igual tanto nos reagentes quanto nos produtos.
Conforme indicado pela equação, são produzidos 3 mols de oxigênio para cada 2 mols de clorato de potássio que sofrem decomposição. Dessa forma, podemos calcular a quantidade de matéria, expressa em número de mols (n), de oxigênio produzida quando 2 mols de clorato de potássio se decompõem. Isso pode ser feito utilizando uma regra de três simples.
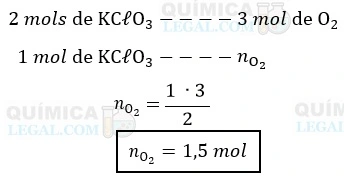
Além disso, no enunciado foram fornecidas informações adicionais sobre o oxigênio produzido, incluindo a temperatura de 273 K, a pressão de 1 atm e a constante universal dos gases (R) de 0,082 L∙atm / K∙mol. Com base nessas informações, podemos utilizar a equação de Clapeyron para calcular o volume do oxigênio produzido pela decomposição de 2 mols de clorato de potássio. Substituindo os valores, temos:

Portanto, o volume de oxigênio produzido a partir da decomposição de 2 mols de clorato de potássio é igual a 33,6 litros, medidos nas condições normais de temperatura e pressão (CNTP). Consequentemente, a alternativa correta é a letra E.
Gabarito: LETRA E



