Todas as constantes de equilíbrio descritas…
(UFVJM-MG) Todas as constantes de equilíbrio descritas a seguir estão corretas em relação à respectiva reação, exceto:
a) N2(g) + 3 H2(g) ⇋ 2 NH3(g)
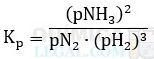
b) CH3COOH(ℓ) + C2H5OH(ℓ) ⇋ CH3COOC2H5(ℓ) + H2O(ℓ)
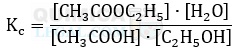
c) H2(g) + 1/2 O2(g) ⇋ H2O(g)
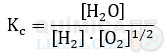
d) CaCO3(s) ⇋ CaO(s) + CO2(g)
![]()
e) H2(g) + I2(s) ⇋ 2 HI(g)
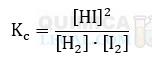
Resolução
A constante de equilíbrio de uma reação química é igual a razão entre as concentrações dos produtos e as concentrações dos reagentes (Kc). No caso de substâncias no estado gasoso, as concentrações são substituídas pelas pressões parciais (Kp).
Na expressão de Kc entram apenas concentrações que podem sofre variações, ou seja, concentrações de substâncias em solução. Já na expressão de Kp, apenas substâncias gasosas são consideradas, pois a pressão parcial de líquidos e sólidos é muito pequena.
Dito isso, a alternativa com a expressão da constante de equilíbrio incorreta é a letra E. Isso porque, as substâncias H2 e HI estão no estado gasoso, logo, as pressões parciais deveriam ser utilizadas. Além disso, o iodo molecular é uma substância sólida, logo, não entra na expressão, pois sua pressão parcial é desprezível. Portanto, a expressão correta seria:
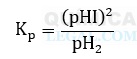
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS sobre EQUILÍBRIOS QUÍMICOS.
Veja também: EXERCÍCIOS DE FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS do UFVJM?



