Uma massa igual a 30 g de uma substância…
(UFBA) Uma massa igual a 30 g de uma substância pura, na fase gasosa, ocupa um volume de 12,3 L à temperatura de 327 °C e à pressão de 3 atm. Calcule a massa molecular dessa substância.
Dado: R = 0,082 atm ∙ L / K ∙ mol.
Resolução
Para resolver essa questão basta substituir os valores na Equação de Clapeyron ou Equação de estado dos gases, como demonstrado a seguir:
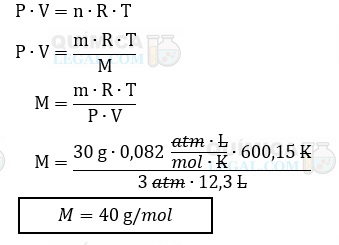
Observações:
- n é igual ao número de mols, que é igual a razão entre a massa (m) e a massa molar (M);
- Para converter a temperatura da escala Celsius para a temperatura absoluta basta somarmos 273,15, ou seja: T(K) = 273,15 + t(°C)
Portanto, a massa molecular da substância em questão é igual a 40 u.
Lembre-se de que a massa molecular (MM) é igual a soma das massas atômicas (MA) dos átomos presente na estrutura da molécula, e é numericamente igual a massa molar (M).
Gabarito: MM = 40 u
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTUDO DOS GASES.
Veja também: EXERCÍCIOS DE FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS do UFBA?


