0,195 g de um metal bivalente foi dissolvido em…
0,195 g de um metal bivalente foi dissolvido em 10 mL de ácido sulfúrico 0,50 mol/L. O excesso de ácido foi neutralizado por 16 mL de hidróxido de potássio 0,25 mol/L. Calcule a massa atômica do metal.
Resolução
Cálculo da quantidade em mols de H2SO4 em 10 mL da solução utilizada para dissolver o metal:
[H2SO4] = nH2SO4 / V
nH2SO4 = [H2SO4] ∙ V
nH2SO4 = 0,50 mol/L ∙ 0,010 L
nH2SO4 = 0,005 mol
Cálculo da quantidade em mols de KOH empregada na titulação do H2SO4 em excesso:
[KOH] = nKOH / V
nKOH = [KOH] ∙ V
nKOH = 0,25 mol/L ∙ 0,016 L
nKOH = 0,004 mol
Agora, vamos escrever a equação química balanceada que representa a neutralização do H2SO4:
2 KOH(aq) + H2SO4(aq) → K2SO4(aq) + 2 H2O(ℓ)
A equação química acima nos diz que a neutralização de 1 mol de H2SO4 consome 2 mols de KOH, logo:
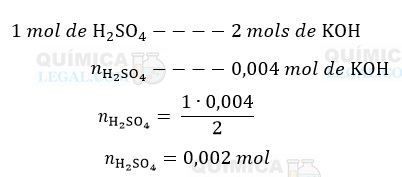
Como sabemos as quantidades total e excedente de H2SO4, podemos calcular a quantidade de H2SO4 que reagiu com o metal:
nH2SO4-REAGIU = nH2SO4 − nH2SO4-EXCESSO
nH2SO4-REAGIU = 0,005 mol – 0,002 mol
nH2SO4-REAGIU = 0,003 mol
Vamos escrever a equação química que representa a reação do H2SO4com o metal bivalente genérico (Me):
Me(s) + H2SO4(aq) → MeSO4(aq) + H2(g)
Observação: os metais bivalentes, devido sua tendência de perder dois elétrons, formam cátions com duas cargas positivas. E os cátions, por sua vez, se ligam a ânions com duas cargas negativas como o sulfato (SO42−).
Conforme a equação química balanceada, 1 mol do metal reage com 1 mol de H2SO4, logo:
nH2SO4-REAGIU = nMETAL = 0,003 mol
Agora que sabemos a massa, 0,195 g, e a quantidade em mols, 0,003 mol, do metal bivalente, podemos calcular a sua massa molar:
MMMETAL = mMETAL / nMETAL
MMMETAL = 0,195 g / 0,003 mol
MMMETAL = 65 g/mol
A massa atômica é numericamente igual a sua massa molar, logo, o metal em questão tem massa atômica igual a 65 u (u = unidade de massa atômica).
Confira mais EXERCÍCIOS RESOLVIDOS sobre VOLUMETRIA DE NEUTRALIZAÇÃO.



