Na indústria, a amônia, NH3, é obtida pelo processo…
(Vunesp-SP) Na indústria, a amônia, NH3, é obtida pelo processo denominado Haber-Bosh, pela reação entre o nitrogênio e o hidrogênio na presença de um catalisador apropriado, conforme mostra a reação não balanceada:
N2(g) + H2(g) + (catalizador) → NH3(g)
Considerando um rendimento de 100%, calcule:
a) a massa de amônia produzida reagindo-se 7 g de nitrogênio, N2, com 3 g de hidrogênio, H2.
b) nas condições descritas no item a, existe reagente em excesso? Se existir, qual a massa em excesso desse reagente?
Resolução
Equação química balanceada:
N2(g) + 3 H2(g) + (catalizador) → 2 NH3(g)
Para a reação de cada mol de N2 são necessários 3 mols de H2. Logo:
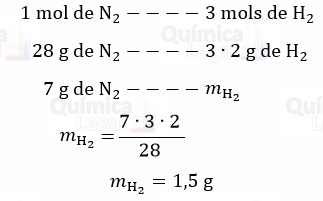
Portanto, o H2 é o reagente em excesso.
De acordo com a equação balanceada, são formados 2 mols de NH3 para cada mol de N2 que reage. Assim, temos:

b) Sim, há 3 g de H2 enquanto são necessários apenas 1,5 g para reagir com 7 g de N2. Portanto, há 1,5 g de H2 em excesso.
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da Vunesp?


