Uma amostra de 340,0 g de salitre do chile…
(UPM-SP) Uma amostra de 340,0 g de salitre do chile, cujo teor em nitrato de sódio, NaNO3, é de 75%, reage com ácido sulfúrico concentrado, H2SO4 (conc.), produzindo bissulfato de sódio, NaHSO4, e ácido nítrico, HNO3.
NaNO3(s) + H2SO4 (conc.) → NaHSO4(aq) + HNO3(aq)
A massa mínima de ácido sulfúrico necessária para reagir com todo o nitrato de sódio é igual a:
a) 392,0 g
b) 147,0 g
c) 522,7 g
d) 73,5 g
e) 294,0 g
Resolução
A massa de NaNO3 presente em 340 g de salitre do chile é dada por:
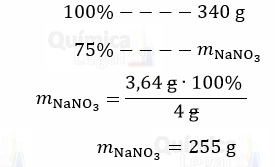
De acordo com a equação química, já balanceada, 1 mol de NaNO3 reage com 1 mol de H2SO4. Logo:
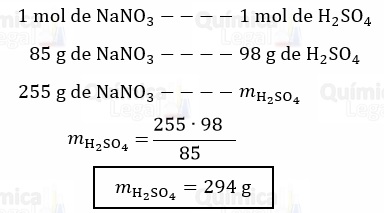
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS de ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da UPM?


