O volume de CO2, medido a 27 °C e 1 atm…
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
O volume de CO2, medido a 27 °C e 1 atm, produzido na combustão de 960,0 g de metano, é:
Dado: R = 0,082 atm∙L / mol∙K
a) 60,0 L.
b) 1.620,0 L.
c) 1.344,0 L.
d) 1.476,0 L.
e) 960,0 L.
Resolução
De acordo com a equação química, já balanceada, é formado 1 mol de CO2 para cada mol de CH4 queimado. Assim, temos:
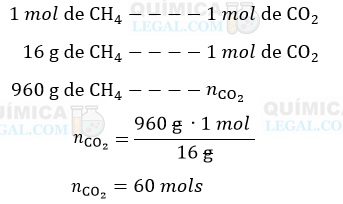
Então, podemos utilizar a equação de Clapeyron para encontrar o volume de 60 mols de CO2 a 27 ºC e 1 atm:

Lembre-se de que: TK = TºC +273
Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da Mackenzie?


