A amônia é obtida industrialmente pela reação…
(UFRGS-RS) A amônia é obtida industrialmente pela reação do nitrogênio do ar com o hidrogênio. Nessa reação, cada três mols de hidrogênio consumidos formam um número de moléculas de amônia aproximadamente igual a:
a) 2,0 × 1023.
b) 3,0 × 1023.
c) 6,0 ×1023.
d) 1,2 × 1024.
e) 1,8 × 1024.
Resolução
A resolução de uma questão de estequiometria torna-se consideravelmente mais simples quando escrevemos a equação química balanceada correspondente à reação. Essa equação garante que as quantidades de átomos de um mesmo elemento químico sejam iguais em ambos os lados da equação, facilitando os cálculos envolvidos. Por exemplo, consideremos a seguinte equação:
N2(g) + 3 H2(g) → 2 NH3(g)
De acordo com essa equação, sabemos que a reação de 3 mols de hidrogênio com 1 mol de nitrogênio produz 2 mols de amônia. Além disso, é conhecido pela constante de Avogadro que há 6,02 × 1023 moléculas (N) em 1 mol de amônia. Portanto, para calcular o número de moléculas em 2 mols de amônia, podemos utilizar uma simples regra de três:
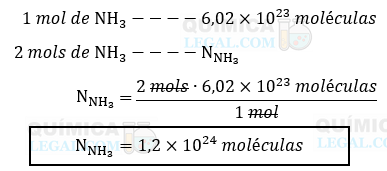
Resolvendo essa proporção, encontramos que o consumo de 3 mols de hidrogênio produz 1,2 × 1024 moléculas de amônia. moléculas de amônia. Assim, através da equação química balanceada e do uso da constante de Avogadro, podemos realizar cálculos precisos e compreender melhor os aspectos quantitativos das reações químicas.
Gabarito: LETRA D
Confira Também
- Exercícios Resolvidos sobre Estequiometria
- Exercícios de Química Geral e Inorgânica Resolvidos
- Resoluções Comentadas da UFRGS
- Livros de Química Resolvidos



