A platina, utilizada no conversor catalítico…
(Química 2, Martha Reis) A platina, utilizada no conversor catalítico dos automóveis para diminuir a emissão de gases poluentes originados na queima incompleta dos combustíveis, pode ser obtida pela seguinte reação balanceada:
3 (NH4)2PtCℓ6(s) → 3 Pt(s) + 2 NH4Cℓ(s) + 2 N2(g) + 16 HCℓ(g)
Supondo que em determinadas condições a reação tenha um rendimento de 60%, responda:
a) Quantos gramas de platina metálica são obtidos pela decomposição térmica de 1.332 g de hexacloro platinato de amônio, (NH4)2PtCℓ6?
b) Qual a massa de (NH4)2PtCℓ6 que deve ser utilizada para fornecer 780 g de platina metálica, Pt(s)?
Resolução
a) Segundo a equação química balanceada, são produzidos 3 mols de platina metálica para cada 3 mols de (NH4)2PtCℓ6 que reagem. Logo:
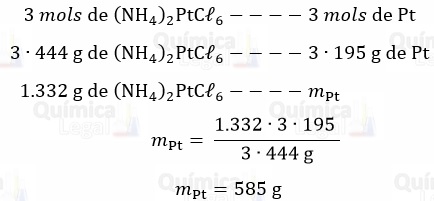
Considerando o rendimento de 60% temos:

b) A massa de (NH4)2PtCℓ6 necessária para produção de 780 gramas de platina é dada por:

Essa seria a massa de (NH4)2PtCℓ6 caso a reação apresentasse 100% de rendimento. Como o rendimento é 60%, a massa necessária para produzir 780 g de platina metálica é dada por:

Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Gostaria de ver mais LIVROS RESOLVIDOS DE QUÍMICA?



