A seguir são fornecidas três tabelas com os dados da…
(Química 2, Martha Reis) A seguir são fornecidas três tabelas com os dados da variação de pressão em função do volume a que um gás X foi submetido, sob temperatura constante:
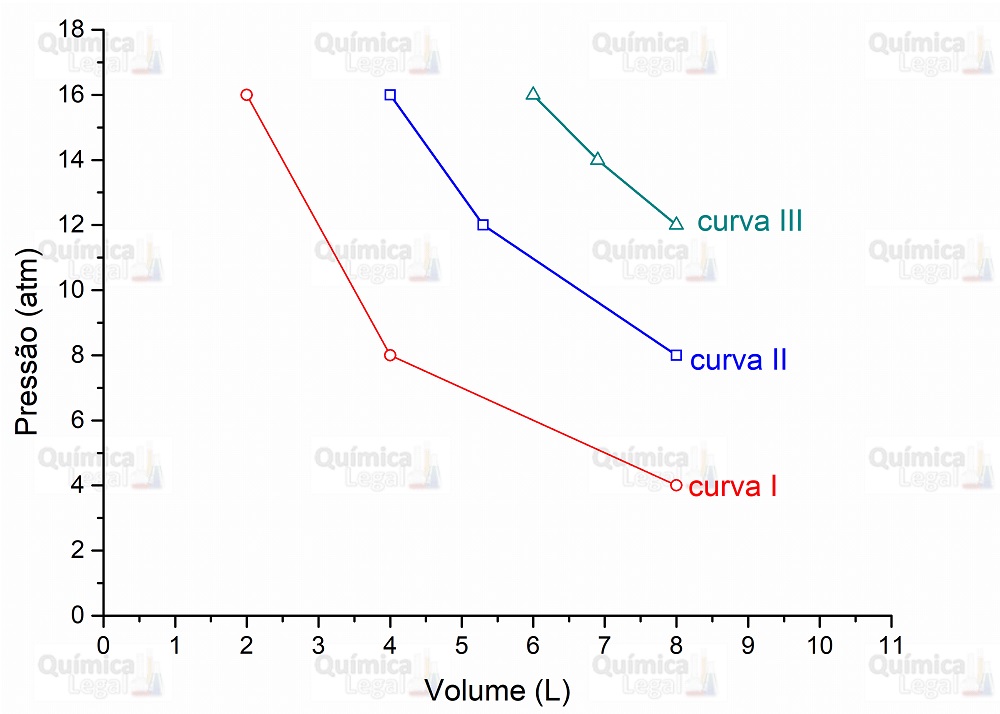
| P/atm | 16 | 8 | 4 |
| V/L | 2 | 4 | 8 |
| P/atm | 16 | 12 | 8 |
| V/L | 4 | 5,3 | 8 |
| P/atm | 16 | 14 | 12 |
| V/L | 6 | 6,9 | 8 |
Em um mesmo gráfico de P (na ordenada) e V (na abscissa), construa as três curvas, uma para cada situação à qual o gás X foi submetido. Indique em qual delas a temperatura do gás X era maior. Por quê?
Resolução
Plotando os dados informados no enunciado, obtemos as três isotermas mostradas na figura abaixo.
Para descobrir em qual das curvas a temperatura é maior, é preciso entendermos o efeito da temperatura na pressão e, consequentemente, no volume dos gases.
As moléculas de um gás ficam mais agitadas a medida que a temperatura aumenta, pois elas estão recebendo energia. Dessa forma, considerando a pressão constante, o gás com temperatura mais alta apresenta um maior volume, porque as moléculas estarão mais desorganizadas devido a maior agitação.
Agora, considerando o volume constante, a pressão também é maior no gás quanto maior for a temperatura. Isso porque as moléculas terão mais energia e a quantidade de choque com a superfície será maior. Lembre-se, a pressão é igual a força (o choque das moléculas) aplicada a uma determinada área (parede do recipiente em que o gás está confinado).
Assim, se fixarmos a pressão em 16 atm, o maior volume é do gás da curva III. E se considerarmos o volume fixo em 8 L, o gás da curva III também é o que apresenta a maior pressão. Portanto, a curva III representa o gás com a temperatura mais alta.
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTUDO DOS GASES.
Gostaria de ver mais LIVROS RESOLVIDOS DE QUÍMICA?



