Cada elemento químico apresenta um espectro…
(UECE) Cada elemento químico apresenta um espectro característico, e não há dois espectros iguais. O espectro é o retrato interno do átomo e assim é usado para identificá-lo, conforme ilustração dos espectros dos átomos dos elementos hidrogênio, hélio e mercúrio.
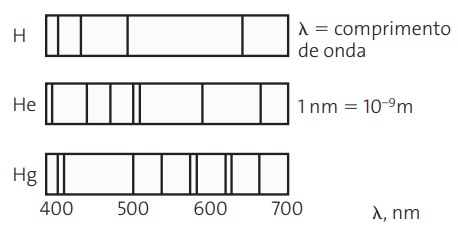
Bohr utilizou o espectro de linhas para representar seu modelo atômico, assentado em postulados, cujo verdadeiro é:
a) ao mudar de órbita ou nível, o elétron emite ou absorve energia superior à diferença de energia entre as órbitas ou níveis onde ocorreu essa mudança.
b) todo átomo possui um certo número de órbitas, com energia constante, chamadas estados estacionários, nos quais o elétron pode movimentar-se sem perder nem ganhar energia.
c) os elétrons descrevem, ao redor do núcleo, órbitas elípticas com energia variada.
d) o átomo é uma esfera positiva que, para tornar-se neutra, apresenta elétrons (partículas negativas) incrustados em sua superfície.
Resolução
a) Falso. Segundo a teoria de Bohr, a quantidade de energia absorvida ou emitida são sempre múltiplos inteiros do fóton, é o que se chama de quantum de energia.
b) Verdadeiro. Um átomo está no seu estado fundamento enquanto os seus elétrons estiverem se movimentando em seus respectivos níveis de energia.
c) Falso. De acordo com Bohr, o elétron move-se em órbitas circulares em torno de um núcleo atômico central.
d) Falso. Essa concepção de átomo encaixa-se no modelo atômico de Thomson.
Gabarito: LETRA B
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTRUTURA ATÔMICA.
Veja também: EXERCÍCIOS DE QUÍMICA GERAL E INORGÂNICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da UECE?



