Calcule o pH de uma solução contendo metaborato…
Calcule o pH de uma solução contendo metaborato de sódio (NaBO2) com concentração igual a 0,1 mol/L.
Dados:
- ka HBO2 (ácido metabórico) = 1,0 × 10-2
- kw (constante de autoprotólise da água) = 1,0 × 10-14
Resolução
Dissociação do metaborato de sódio (NaBO2) em água:
NaBO2(s) + H2O(ℓ) → HBO2(aq) + NaOH(aq)
A partir da equação acima, temos a seguinte relação:
[HBO2] = [NaOH]
A concentração de ionização de NaBO2 (kb) pode ser representada por:
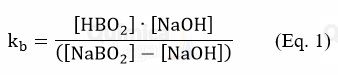
A partir da constante de acidez (ka) do HBO2, informado no enunciado, podemos calcular o kb de NaBO2 como mostrado a seguir:
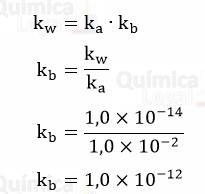
Como kb é muito baixo, teremos uma quantidade muito baixa de NaOH, temos a seguinte relação:
[NaBO2] >>> [NaOH]
Reescrevendo a equação 1, temos:
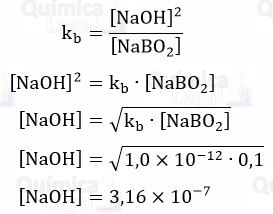
Sabemos que NaOH é uma base forte, e que em solução aquosa se dissocia totalmente conforme a equação abaixo:
NaOH(s) → Na+(aq) + OH–(aq)
Logo: [NaOH] = [OH–]
Então, podemos calcular a concentração de H3O+ da seguinte maneira:
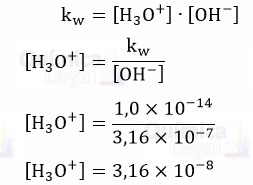
Por fim, basta calcular o pH da solução aplicando o antilogaritimo à concentração de H3O+.
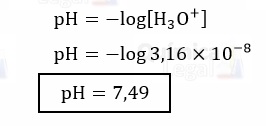
Confira mais EXERCÍCIOS RESOLVIDOS sobre EQUILÍBRIOS QUÍMICOS.



