Considerando os gases estomacais: nitrogênio…
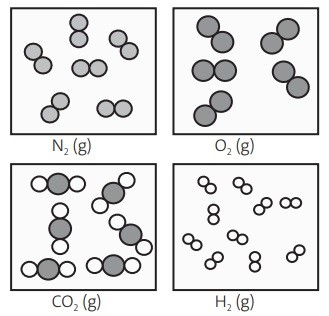
(UEL-PR) Considerando os gases estomacais: nitrogênio, N2, oxigênio, O2, hidrogênio, H2, e dióxido de carbono, CO2, e observando a figura a seguir, quais deles estão sob a mesma temperatura e mesma pressão? O tamanho das moléculas dos gases não está em escala real, encontra-se ampliado em relação ao volume constante e igual do recipiente que as contém, para efeito de visualização e diferenciação das espécies.
a) N2 e O2
b) H2 e N2
c) O2 e CO2
d) O2 e H2
e) CO2 e N2
Resolução
Equação de Clapeyron:

onde: P = pressão; T = temperatura; V = volume; n = número de mols e R = constnate.
De acordo com a equação de Clapeyron, dois gases com mesmo volume, temperatura e pressão, terão necessariamente o mesmo número de mols e a mesma quantidade de moléculas.
Dessa forma, para descobrir quais dos gases estomacais, dentre os listados no enunciado, estão sob a mesma temperatura e mesma pressão, basta verificar quais tem a mesma quantidade de moléculas na figura.
- N2: 6 moléculas
- O2: 5 moléculas
- CO2: 6 moléculas
- H2: 10 moléculas
Portanto, o gás nitrogênio, N2, e o gás carbônico, CO2, estão sob a mesma temperatura e mesma pressão.
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTUDO DOS GASES.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da UEL?



