Considere a experiência: a uma solução aquosa que…
(FUVEST-SP) Considere a experiência: a uma solução aquosa que contém 10,0 g de hidróxido de sódio adicionam-se lentamente 9,8 g de ácido sulfúrico puro e depois água, de modo a obter-se 1 L de solução.
a) Representar com fórmulas químicas a reação que ocorreu nessa experiência.
b) Calcular a massa de hidróxido de sódio que não reagiu com o ácido.
Dados: M(H2SO4) = 98 g/mol; M(NaOH) = 40 g/mol
Resolução
a) O hidróxido de sódio é uma base forte, enquanto o ácido sulfúrico é um ácido forte. Assim, ocorre uma reação de neutralização entre essas duas substâncias, como mostrado a seguir:
2 NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2 H2O(ℓ)
b) De acordo com a equação acima, a qual já está balanceada, 2 mols de NaOH reagem com 1 mol de H2SO4. Assim, a massa de NaOH necessária para reagir com 9,8 g de H2SO4 é dada por:
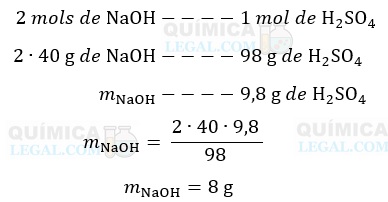
Dessa forma, a massa de hidróxido de sódio que não reagiu com o ácido sulfúrico é dada por:
m(NaOH)restante = m(NaOH)total – m(NaOH)reagiu
m(NaOH)restante = 10 g – 8 g
m(NaOH)restante = 2 g
Portanto, 2 g de hidróxido não reagiu com o ácido sulfúrico.
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Gostaria de ver mais RESOLUÇÕES COMENTADAS da FUVEST?


