Em setembro de 1998, cerca de 10.000 toneladas…
(Enem 1998) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico, H2SO4, foram derramadas pelo navio Bahamas no litoral do Rio Grande do Sul. Para minimizar o impacto ambiental de um desastre desse tipo, é preciso neutralizar a acidez resultante. Para isso pode-se, por exemplo, lançar calcário, minério rico em carbonato de cálcio, CaCO3, na região atingida. A equação química que representa a neutralização do H2SO4 por CaCO3, com a proporção aproximada entre as massas dessas substâncias é:
H2SO4(aq) + CaCO3(s) → CaSO4(s) + H2O(ℓ) + CO2(g)
1 tonelada reage com 1 tonelada sólido sedimentado gás
Pode-se avaliar o esforço de mobilização que deveria ser empreendido para enfrentar tal situação, estimando a quantidade de caminhões necessária para carregar o material neutralizante. Para transportar certo calcário que tem 80% de CaCO3(s), esse número de caminhões, cada um com carga de 30 toneladas, seria próximo de:
a) 100.
b) 200.
c) 300.
d) 400.
e) 500.
Resolução
De acordo com a equação química, já balanceada, a neutralização de 1 tonelada de H2SO4 requer 1 tonelada de CaCO3. Logo, para neutralizar 10.000 toneladas de H2SO4 serão necessárias 10.000 toneladas de CaCO3.
Segundo o enunciado, o calcário usado na neutralização apresenta 80% de CaCO3. Assim, a massa de calcário é dada por:
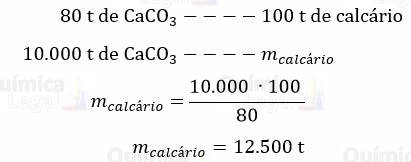
Se cada caminhão carrega 30 toneladas de calcário, temos:

Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS de ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da Enem?



