Fórmulas eletrônicas e estruturais de compostos
(IME) Apresente as fórmulas eletrônicas e estruturais do trióxido de enxofre, do hidróxido de sódio e do perclorato de cálcio.
Resolução
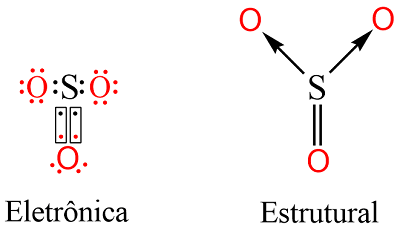
O trióxido de enxofre (SO3) é formado por átomos de enxofre (S) e oxigênio (O) ligados covalentemente. Esses átomos pertecem ao grupo 16 da tabela periódica, logo, precisam de dois elétrons para completar o octeto e atingir a estabilidade. Assim, o átomo de enxofre compartilha dois pares de elétrons (ligação dupla) com um átomo de oxigênio e faz duas ligações coordenadas com outros dois átomos de oxigênio. Este último tipo de ligação, representada por setas, ocorre quando o par de elétron compartilhado é proveniente de apenas um átomo.
O hidróxido de sódio (NaOH) é uma base forte obtida pela elétrolise da salmoura (NaCl) e formado pela ligação de um átomo de sódio (Na), um grupo hidroxila(OH−). O grupo hidroxila, por sua vez é formado pela ligação covalente entre 1 átomo de hidrogênio (H) e um átomo de oxigênio (O).
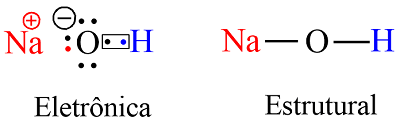
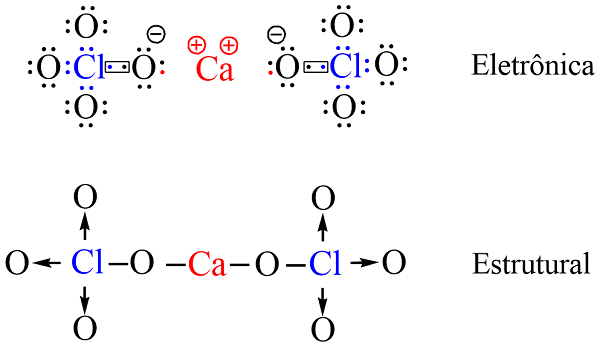
O perclorato de cálcio (Ca(CℓO4)2) é formado pela ligação iônica entre um cátion Ca2+ e dois ânions CℓO4−. O cálcio está no grupo dos metais alcalinos terrosos na tabela periódica. Átomos desse grupo se caracterizam pela tendência de perder dois elétrons para atingir a estabilidade. Sendo assim, o átomo de cálcio cede dois elétrons para átomos de oxigênio, formando os íons.
Os ânions CℓO4−, são formado a partir da ligação covalente entre 1 átomo de cloro e 4 átomos de oxigênio. Três destas ligações são coordenadas, ou seja, ligações onde o par de elétron compartilhado pertence apenas ao átomo de cloro.
Confira mais EXERCÍCIOS RESOLVIDOS sobre LIGAÇÕES QUÍMICAS.
Veja também: EXERCÍCIOS DE QUÍMICA GERAL E INORGÂNICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS do IME?


