Na investigação forense, utiliza-se luminol…
(Enem 2005) Na investigação forense, utiliza-se luminol, uma substância que reage com o ferro presente na hemoglobina do sangue, produzindo luz que permite visualizar locais contaminados com pequenas quantidades de sangue, mesmo superfícies lavadas. É proposto que, na reação do luminol (I) em meio alcalino, na presença de peróxido de hidrogênio (II) e de um metal de transição (M(n)+, que após uma relaxação, dá origem ao produto final da reação (IV), que é o 3-aminoftalato com liberação de energia (hν) e de gás nitrogênio (N2).
(Adaptado. “Química Nova”, 25, no 6, 2002. pp. 1003-10)
Dados – Pesos Moleculares
- Luminol = 177 g/mol
- 3-aminoftalato = 164 g/mol
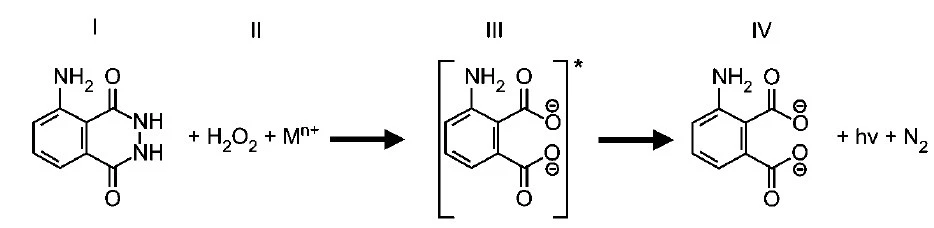
Na análise de uma amostra biológica para análise forense, utilizou-se 54 g de luminol e peróxido de hidrogênio em excesso, obtendo-se um rendimento final de 70 %. Sendo assim, a quantidade, em gramas, de 3-aminoftalato (IV) formada na reação foi de:
a) 123,9
b) 114,8
c) 86,0
d) 35,0
e) 16,2
Resolução
Com base na equação química fornecida, onde 1 mol de luminol reage para produzir 1 mol de 3-aminoftalato, e utilizando as massas molares conhecidas (177 g/mol para o luminol e 164 g/mol para o 3-aminoftalato), podemos calcular a massa de 3-aminoftalato produzida a partir de 54 g de luminol. Para realizar esse cálculo, empregamos uma regra de três simples, como demonstrado abaixo:

No entanto, ao levar em consideração o rendimento da reação, fixado em 70%, ajustamos a proporção utilizando novamente uma regra de três simples:

Portanto, considerando o rendimento da reação, a massa de 3-aminoftalato produzida é igual a 35 g. Assim, a alternativa correta é a letra D.
Gabarito: LETRA D
- Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
- Veja também: EXERCÍCIOS DE QUÍMICA GERAL E INORGÂNICA
- Gostaria de ver mais RESOLUÇÕES COMENTADAS do Enem?



