No balão A, são adicionados carbonato de sódio e…
(UFRRJ 2005) Observe a figura e leia o texto.
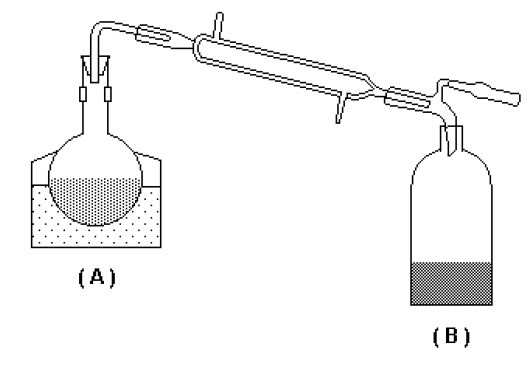
No balão A, são adicionados carbonato de sódio e ácido clorídrico em quantidades suficientes para a produção de 11,2 litros de um gás, nas CNTP, sendo que este gás foi borbulhado em 1,0 L de uma solução de hidróxido de cálcio no balão B, cuja concentração é de 37 g/L.
Após a absorção total do gás no balão B, formou-se uma substância pouco solúvel que permanece depositada no fundo do referido balão.
a) Escrevas as reações balanceadas que ocorrem nos balões A e B.
b) Calcule a massa da substância que se deposita no fundo do balão B.
Dado: R = 0,082 atm ∙ L / mol ∙ K
Resolução
a) No balão A, o carbonato de sódio reage com o ácido clorídrico, formando como produto o gás de carbono, água e cloreto de sódio:
Na2CO3(s) + 2 HCℓ(aq) → CO2(g) + H2O(ℓ) + NaCℓ(aq)
O gás carbônico produzido no balão A é, segundo o enunciado, borbulhado no balão B, onde há hidróxido de cálcio. Dessa forma, no balão B há a formação de carbonato de cálcio e água.
CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O(ℓ)
b) De acordo com o enunciado os 11,2 L de CO2 produzidos no balão A foram completamente absorvidos no balão B. Assim, sabemos que o CO2 é o reagente limitante da reação que ocorre no balão B.
Então, agora precisamos converter o CO2 em quantidade de matéria. Para isso, podemos utilizar a equação de Clapeyron:

Conforme a segunda equação química, já balanceada, é formado 1 mol de CaCO3 para cada mol de CO2 que reage. Logo, temos:
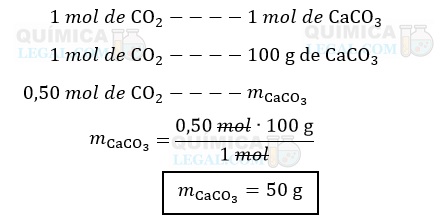
Portanto, a massa da substância depositada no fundo do balão B, CaCO3, é igual a 50 g.
Confira mais EXERCÍCIOS RESOLVIDOS de ESTEQUIOMETRIA.
Veja mais RESOLUÇÕES COMENTADAS da UFRRJ.


