O ácido acetilsalicílico (AAS) é um dos medicamentos…
O ácido acetilsalicílico (AAS) é um dos medicamentos mais utilizados no mundo inteiro. Sua obtenção pode ser feita por meio da reação do ácido salicílico com ácido acético, catalisada pela presença de um ácido forte.
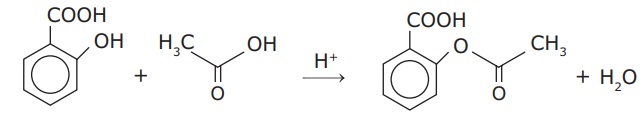
Supondo que essa reação ocorra com um rendimento de 80%, determinar o número de moléculas de aspirina produzidas, quando se faz reagir 27,6 gramas do ácido salicílico com ácido acético suficiente.
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
Segundo a equação química apresentada, a qual já está balanceada, é produzido 1 mol de AAS a partir da reação de 1 mol de ácido salicílico. Assim, temos:

Dessa forma, a reação de 27,6 g de ácido salicílico produz 0,2 mol de AAS. Porém, o rendimento da reação é de 80%, logo a quantidade de matéria de AAS de fato produzida é dada por:
nAAS = 0,2 mol ∙ (80%/100%)
nAAS = 0,2 mol ∙ 0,8
nAAS = 0,16 mol
Agora, precisamos converter essa quantidade de matéria em número de moléculas. E para isso vamos utilizar a constante de Avogadro (NA), a qual nos diz que em 1 mol de AAS há 6,02×1023 moléculas de AAS. Assim, temos:
NAAS = NA ∙ nAAS
NAAS = 6,02×1023 moléculas/mol ∙ 0,16 mol
NAAS = 9,63×1022 moléculas
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.


