O cloreto em 0,12 g de amostra 95% pura de…
O cloreto em 0,12 g de amostra 95% pura de MgCℓ2 foi precipitado como AgCℓ. Calcule o volume de uma solução de AgNO3 0,1 mol/L requerida para precipitar o cloreto e dar um excesso de 10%.
Massas molares (g/mol): AgNO3 = 169,9; MgCℓ2 = 95,3.
Resolução
Como a pureza do cloreto de magnésio é igual a 95%, temos:

Dissociação do cloreto de magnésio e do nitrato de prata:
MgCℓ2(s) → Mg2+(aq) + 2 Cℓ–(aq)
AgNO3(s) → Ag+(aq) + NO3–(aq)
Precipitação do cloreto de prata:
2 Cℓ–(aq) + 2 Ag+(aq) → 2 AgCℓ(s)
A precipitação do cloreto proveniente de 1 mol de MgCℓ2 requer a adição de 2 mols de AgNO3. Assim, temos:
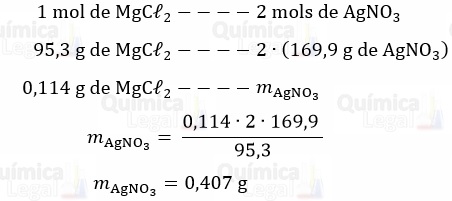
Segundo o enunciado, o AgNO3 deve ser adicionado com um excesso de 10%. Logo:

Transformando a concentração da solução de AgNO3 de mol/L para g/L:
C = [AgNO3] ∙ MM
C = 0,1 mol/L ∙ 169,9 g/mol
C = 16,99 g/L
Para finalizar, basta calcular o volume:

Confira mais EXERCÍCIOS RESOLVIDOS sobre GRAVIMETRIA.


