O gás cloro é produzido industrialmente a partir do…
(Química 1, Peruzzo e Canto) O gás cloro é produzido industrialmente a partir do cloreto de sódio. Em laboratório, contudo, quando é necessária pequena quantidade desse gás, pode se obtê-lo por meio da reação entre o dióxido de manganês e o ácido clorídrico, que pode ser assim equacionada:
MnO2(s) + 4 HCℓ(aq) → MnCℓ2(aq) + 2 H2O(ℓ) + Cℓ2(g)
Nessa reação, deseja-se utilizar 29 g de dióxido de manganês.
a) Quantos mols de HCℓ são necessários?
b) Quantas moléculas de cloro serão produzidas?
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
a) A proporção estequiométrica, conforme a equação química balanceada, é de 1 mol de MnO2 para 4 mols de HCℓ. Assim, a quantidade em mols de HCℓ necessário para reagir com 29 g de MnO2 é dada por:

Portanto, é necessário 1,33 mol de ácido clorídrico para reagir com 29 g de óxido de manganês.
b) A equação química nos diz que é produzido 1 mol de moléculas de Cℓ2 para cada mol de MnO2 que reagem. E, de acordo com a constante de Avogadro, em 1 mol de uma determinada espécie, há 6,0 × 1023 espécies. Assim, temos:
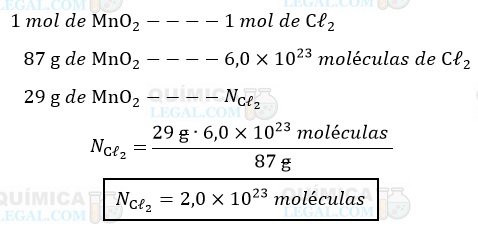
Portanto, a reação de 29 g de óxido de manganês produz 2,0 × 1023 moléculas de Cℓ2.
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Gostaria de ver mais LIVROS RESOLVIDOS DE QUÍMICA?


