O gás engarrafado, usualmente consumido como…
(Univali-SC) O gás engarrafado, usualmente consumido como combustível em fogões, é mistura de hidrocarbonetos derivados do petróleo, constituída, predominantemente, de butano, C4H10 (C = 12, H = 1). Uma dona de casa, utilizando-se seus conhecimentos em Termoquímica e sabendo que a quantidade de calor produzida em seu fogão, devido à combustão do butano, foi de 60.000 kJ, calculou que o botijão de gás utilizado apresenta uma diminuição de massa de:
C4H10(g) + 13/2 O2(g) → 4 CO2(g) + 5 H2O(g)
∆H = − 2.900 kJ
a) 1,0 kg.
b) 1,2 kg.
c) 2,8 kg.
d) 3,2 kg.
e) 4,4 kg.
Resolução
De acordo com a equação química balanceada, a combustão de 1 mol de C4H10 produz 2.900 kJ de energia na forma de calor. Assim, a quantidade de matéria de gás queimado suficiente para produzir 60.000 kJ de energia é dada por:
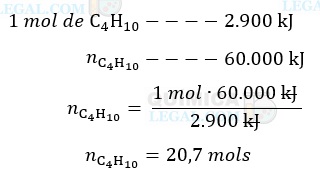
Por fim, basta multiplicar a quantidade de matéria (n) pela massa molar do gás (MM), conforme mostrado a seguir:
m = MM ∙ n
m = 58 g/mol ∙ 20,7 mols
m = 1.200 g
m = 1,2 kg
Lembre-se de que: 1 kg = 1.000 g.
Portanto, a redução do peso do botijão foi de 1,5 kg.
Gabarito: LETRA B
Confira mais EXERCÍCIOS RESOLVIDOS sobre TERMOQUÍMICA.
Veja também: FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da Univali?


