Os comprimidos de um certo antiácido efervescente…
(FUVEST-SP) Os comprimidos de um certo antiácido efervescente contêm ácido acetilsalicílico, ácido cítrico e determinada quantidade de bicarbonato de sódio, que não é totalmente consumida pelos outros componentes, quando o comprimido é dissolvido em água. Para determinar a porcentagem em massa do bicarbonato de sódio (NaHCO3) nesses comprimidos, foram preparadas 7 soluções de vinagre, com mesmo volume, porém de concentrações crescentes. Em um primeiro experimento, determinou-se a massa de um certo volume de água e de um comprimido do antiácido. A seguir, adicionou-se o comprimido à água, agitou-se e, após cessar a liberação de gás, fez-se nova pesagem. Procedimento análogo foi repetido para cada uma das 7 soluções. Os resultados desses 8 experimentos estão no gráfico.

Considerando desprezível a solubilidade do gás na água e nas soluções utilizadas, a porcentagem em massa de bicarbonato de sódio nos comprimidos de antiácido é, aproximadamente, de
Dados:
- massa do comprimido = 3,0 g
- massas molares (g/mol): dióxido de carbono = 44, bicarbonato de sódio = 84
- vinagre = solução aquosa diluída de ácido acético
a) 30
b) 55
c) 70
d) 85
e) 90
Resolução
Equação balanceada da reação de neutralização entre o ácido acético, presente na solução de vinagre, e o bicarbonato de sódio (NaHCO3), presente no comprimido:
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + H2O(ℓ) + CO2(g)
De acordo com o gráfico, a perda de massa se estabiliza em 1,1 g a partir do quinto experimento. Isso significa que a concentração da solução do vinagre do quinto experimento é suficiente para reagir com todo o NaHCO3 do comprimido.
A perda de massa da solução é referente a formação do gás carbônico (CO2).
A equação de neutralização nos mostra que a reação de 1 mol de NaHCO3 produz 1 mol de CO2. Assim, podemos calcular a massa de NAHCO3 necessária para produzir 1,1 g de CO2:
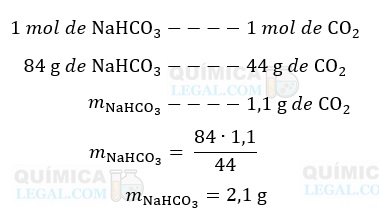
Para finalizar, basta converter a massa acima em porcentagem, considerando que 3 g, massa do comprimido, seja 100%:
p = (mNaHCO3/mCOMPRIMIDO) ∙ 100%
p = (2,1 g/3,0 g) ∙ 100%
p = 0,7 ∙ 100%
p = 70%
Gabarito: LETRA C
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Gostaria de ver mais RESOLUÇÕES COMENTADAS da FUVEST?



