O óxido de alumínio é utilizado como antiácido…
(UFRRJ) O óxido de alumínio (Aℓ2O3) é utilizado como antiácido. Sabendo-se que a reação que ocorre no estômago é:
Aℓ2O3 + 6 HCℓ → 2 AℓCℓ3 + 3 H2O
a massa desse óxido que reage com 0,25 mol de ácido será:
a) 3,25 g.
b) 4,25 g.
c) 5,35 g.
d) 6,55 g.
e) 7,45 g.
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
Segundo a equação química apresentada, a qual já está balanceada, 1 mol de Aℓ2O3 reage com 6 mols de HCℓ. Assim, a massa de óxido de alumínio produzida a partir de 0,25 mol de HCℓ é dada por:
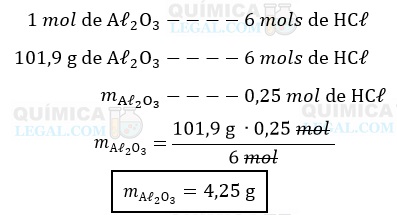
Gabarito: LETRA B
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da UFRRJ?



