Os gráficos I e II esquematizados a seguir representam…
(UFG-GO) Os gráficos I e II esquematizados a seguir representam a variação de temperatura de dois sistemas distintos em função do tempo de aquecimento, mostrando as temperaturas em que ocorrem as transições de fases.
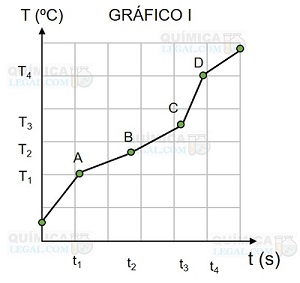

Pela análise desses gráficos, é correto afirmar:
01. Para temperaturas inferiores a T1, podem coexistir duas fases em ambos os sistemas.
02. No sistema II existe uma fase sólida, no ponto A, à temperatura T1, enquanto no ponto B existe uma fase líquida à mesma temperatura.
04. No sistema II só ocorrem duas fases às temperaturas T1 e T2.
08. Representam as transições de fases que podem ocorrer em sistemas que contêm duas substâncias pelo menos.
16. No ponto B, no ponto C e entre ambos, no sistema II, existe uma única fase líquida.
32. Acima do ponto D há uma única fase de vapor em aquecimento, em ambos os sistemas.
Resolução
01. Errado. Basta observar nos dois gráficos que as transformações começam a ocorrer acima da temperatura T1.
02. Correto. O patamar entre os pontos A e B equivale ao tempo de duração da mudança de estado. Durante a mudança, que ocorre à temperatura constante, haverá um equilíbrio entre os estados sólido e líquido.
04. Correto. Pois para visualizar o equilíbrio entre três fases por exemplo, precisaríamos de um diagrama de fases ternário.
08. Errado. O gráfico II é referente a transições de fase de apenas uma substância. Sabemos disso pelos dois patamares que indicam a alteração de estado a temperatura constante.
16. Correto. Observe no gráfico que entre os pontos A e B a transição de sólido para o líquido, ou seja, as duas fases estão em equilíbrio. A partir do ponto B, que é quando a temperatura volta a aumentar, todo sólido já se transformou em líquido. E como sabemos que esse gráfico é referente a uma única substância, temos que do ponto B até o ponto C há apenas uma fase líquida.
32. Correto. No gráfico II é fácil perceber que acima do ponto há apenas uma fase gasosa, pois como discutido anteriormente esse gráfico é referente a uma única substância. No gráfico I temos as transições de fase de uma mistura, então acima do ponto D há a fase gasosa de mais do que uma substância. Então porque há apenas uma única fase gasosa? Simples, os gases sempre formam misturas homogêneas.
SOMA: 54
Confira mais EXERCÍCIOS RESOLVIDOS sobre MATÉRIA E SUAS TRANSFORMAÇÕES.
Gostaria de ver mais RESOLUÇÕES COMENTADAS da UFG?


