Qual o volume de uma solução de hidróxido de…
Qual o volume de uma solução de hidróxido de magnésio – Mg(OH)2 – 0,4 mol/L necessário para neutralizar 80 mL de ácido clorídrico (HCℓ) 1,5 mol/L?
Resolução
Cálculo da quantidade de matéria de HCℓ em 80 mL de solução:
[HCℓ] = n(HCℓ) / V
n(HCℓ) = [HCℓ] ∙ V
n(HCℓ) = 1,5 mol/L ∙ 0,080 L
n(HCℓ) = 0,12 mol
Reação de neutralização do ácido clorídrico:
2 HCℓ(aq) + Mg(OH)2(aq) → MgCℓ2(aq) + 2 H2O(ℓ)
Conforme a equação balanceada, a neutralização de 2 mols de ácido clorídrico consome 1 mol de Mg(OH)2. Assim, temos:
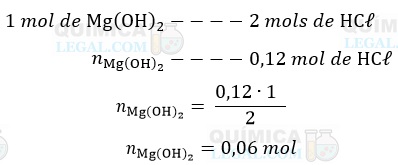
Como a concentração da solução de Mg(OH)2 é igual a 0,4 mol/L, o volume necessário para neutralização do ácido clorídrico é dado por:

Confira mais EXERCÍCIOS RESOLVIDOS sobre VOLUMETRIA DE NEUTRALIZAÇÃO.


