Sabendo-se que, nas CNPT, 1 mol de qualquer gás…
(UFJF-MG) Sabendo-se que, nas CNPT, 1 mol de qualquer gás ocupa um volume igual a 22,4 L, determine a massa, em gramas, de gás carbônico que se obtém, quando se provoca a combustão completa de 5,6 L do gás metano nas CNPT.
a) 22,4
b) 5,6
c) 28
d) 44
e) 11
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
Reação de combustão completa do metano:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
A equação química balanceada nos diz que a queima de 1 mol de CH4 produz 1 mol de CO2. Além disso, segundo o enunciado, em condições normais de temperatura e pressão (CNTP), o volume de 1 mol de qualquer gás é igual a 22,4 L. Assim, temos:
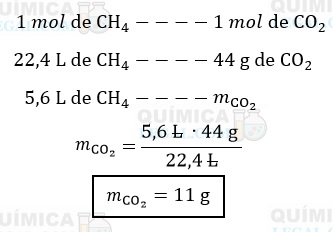
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da UFJF?



