Sabões são sais de ácidos carboxílicos de cadeia longa…
(Enem 2009) Sabões são sais de ácidos carboxílicos de cadeia longa utilizados com a finalidade de facilitar, durante processos de lavagem, a remoção de substâncias de baixa solubilidade em água, por exemplo, óleos e gorduras. A figura a seguir representa a estrutura de uma molécula de sabão.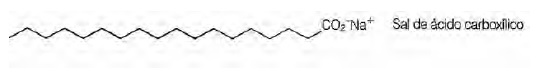 Em solução, os ânions do sabão podem hidrolisar a água e, desse modo, formar o ácido carboxílico correspondente. Por exemplo, para o estearato de sódio, é estabelecido o seguinte equilíbrio:
Em solução, os ânions do sabão podem hidrolisar a água e, desse modo, formar o ácido carboxílico correspondente. Por exemplo, para o estearato de sódio, é estabelecido o seguinte equilíbrio:
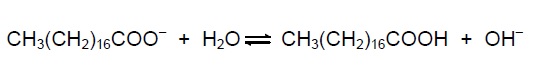 Uma vez que o ácido carboxílico formado é pouco solúvel em água e menos eficiente na remoção de gorduras, o pH do meio deve ser controlado de maneira a evitar que o equilíbrio acima seja deslocado para a direita.
Uma vez que o ácido carboxílico formado é pouco solúvel em água e menos eficiente na remoção de gorduras, o pH do meio deve ser controlado de maneira a evitar que o equilíbrio acima seja deslocado para a direita.
Com base nas informações do texto, é correto concluir que os sabões atuam de maneira
a) mais eficiente em pH básico.
b) mais eficiente em pH ácido.
c) mais eficiente em pH neutro.
d) eficiente em qualquer faixa de pH.
e) mais eficiente em pH ácido ou neutro.
Resolução
De acordo com enunciado, a presença de ácidos carboxílicos na água diminui a eficiência dos sabões de ácidos carboxílicos. Sendo assim, visando garantir o aumento da eficiência do sabão, deve-se garantir o deslocamento da reação para a esquerda (lado dos reagentes), ou seja, para a formação do íon estearato.
Segundo o princípio de Le Chatellier, o equilíbrio de uma reação química é deslocado devido uma pertubação no sistema. E uma das maneiras de fazer essa pertubação consiste em aumentar ou diminuir a concentração das substâncias envolvidas.
Dessa forma, se aumentarmos a quantidade de um dos reagentes, a reação será deslocada para formação dos produtos. Por outro lado, se aumentarmos a quantidade de um dos produtos o equilíbrio será deslocado para a formação dos reagentes.
Dito isso, a equação química apresentada no enunciado, demostra a possibilidade de deslocar o equilíbrio para a formação do íon estearato simplesmente aumentando a quantidade de íons hidroxila (OH–). O aumento desses íons pode ser conseguido elevando-se o pH do sistema.
Portanto, os detergentes serão mais eficientes em pH básico e a alternativa com a resposta correta é a letra A.
Gabarito: LETRA A
Confira mais EXERCÍCIOS RESOLVIDOS sobre CADEIAS CARBÔNICAS.
Tá afim de ver mais RESOLUÇÕES COMENTADAS do ENEM?



