Se 32 g de enxofre reagem com 32 g de oxigênio produzindo…
(Unifor-CE) “Se 32 g de enxofre reagem com 32 g de oxigênio produzindo o anidrido sulfuroso, então 8,0 g de enxofre reagirão com x de oxigênio produzindo y de SO2”. Os valores de x e y que completam corretamente a afirmativa acima são:
| x | y | |
|---|---|---|
| a) | 32 | 64 |
| b) | 32 | 32 |
| c) | 16 | 24 |
| d) | 16 | 16 |
| e) | 8 | 16 |
Resolução
A reação entre o enxofre (S) e o oxigênio (O2) para produzir anidrido sulfuroso (SO2) pode ser expressa pela seguinte equação química balanceada:
S(s) + O2(g) → SO2(g)
Conforme postulado pela Lei de Lavoisier, que estabelece a conservação da massa em um sistema fechado durante uma reação química, a massa total dos reagentes é igual à massa total dos produtos. Assim, podemos afirmar que a massa de SO2 formada é equivalente à soma das massas do enxofre e do oxigênio envolvidos na reação. Portanto:
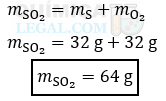
Seguindo a Lei de Proust, que estipula que as substâncias se combinam em proporções fixas e definidas para formar compostos, podemos concluir que o oxigênio e o enxofre se combinam na proporção de 1 para 1. Assim, se 8g de oxigênio estão envolvidos na reação, então a massa de oxigênio é igual a 8g. Como anteriormente determinado, a massa de anidrido sulfuroso resulta da soma das massas de oxigênio e enxofre, o que nos leva a:

Portanto, concluímos que a alternativa que contém os valores corretos de x e y é representada pela letra E.
Gabarito: LETRA E


