Um estudante coletou 0,16 g de um determinado gás…
(CESGRANRIO-RJ) Um estudante coletou 0,16 g de um determinado gás, a 300 K, em um recipiente de 150 mL, e verificou que a pressão do gás era de 0,164 atm. (Nota: considere o gás ideal.) A partir desses dados, pode-se afirmar que a massa molecular desse gás é:
(Dado: R = 0,082 atm.L/.mol.K)
a) 2.
b) 8.
c) 16.
d) 32.
e) 160.
Resolução
Podemos, utilizando a equação de Claperyon, calcular a quantidade de matéria (n) do gás, como mostrado a seguir:
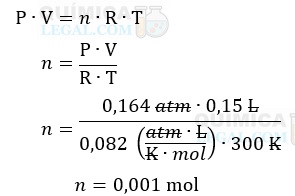
Lembre-se de que: 1.000 mL = 1 L
A massa molar (MM) do gás é equivalente a razão entre a massa (m) e a quantidade de matéria (n), logo:
MM = m / n
MM = 0,16 g / 0,001 mol
MM = 160 g/mol
Portanto, a massa molecular do gás é igual a 160 u.
Observação: u = unidade de massa atômica e 1 u = 1 g/mol.
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTUDO DOS GASES.
Veja também: FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da CESGRANRIO?



