Uma “água dura” contém íons Ca2+ e Mg2+, que…
(UFSCar-SP) Uma “água dura” contém íons Ca2+ e Mg2+, que interferem na ação do sabão e deixam um resíduo nas paredes de tanques e caldeiras. É possível “amolecer” uma “água dura” adicionando-se substâncias que retiram estes íons e liberam, em seu lugar, íons Na+. Se uma “água dura” contém 0,010 mol/L de Ca2+ e 0,005 mol/L de Mg2+, quantos mols de Na+ são necessários para substituir os íons de cálcio e magnésio em 1,0 × 103 L desta água?
a) 10
b) 15
c) 20
d) 30
e) 40
Resolução
Primeiramente vamos calcular a quantidade de matéria dos íons Ca2+ e Mg2+em 1,0 × 103 L (1.000 L) de água. Para isso, basta lembrarmos que a concentração em mol/L é dada pela divisão entre o número de mols do soluto e o volume da solução em litros. Assim, temos:
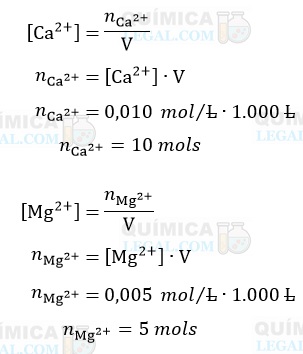
A precipitação dos íons Ca2+ e Mg2+ pode ser representada, genericamente, pela equação química abaixo:
Ca2+(aq) + Mg2+(aq) + 2 X2−(aq) → CaX(s) + MgX(s)
Dessa forma, a precipitação de 1 mol de cada íon, Ca2+ e Mg2+, requer a adição de 2 mols do ânion X2−. Logo, para precipitar 15 mols dos íons combinados (10 mols de Ca2+ + 5 mols Mg2+), deve-se adicionar 15 mols do ânion X2−.
O ânion X2− pode ser obtido pela dissociação do sal Na2X, representada pela equação química abaixo:
Na2X(s) → 2 Na+(aq) + X2−(aq)
Segundo a equação acima, são formados 2 mols de Na+ para cada mol de X2− produzido. Logo, a adição de 15 mols de X2− é acompanhada pela adição de 30 mols de Na+.
Portanto, a substituição dos íons Ca2+ e Mg2+, presentes em 1,0 × 103 litros de “água dura”, requer a adição de 30 mols de íons Na+.
Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS sobre SOLUÇÕES.
Veja também: FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da UFSCar?


