Por seu papel nos batimentos cardíacos…
(UPM-SP) Por seu papel nos batimentos cardíacos, na contração muscular, etc., o potássio é imprescindível ao funcionamento do nosso organismo. Além da banana “nanica”, uma fonte de potássio é a uva-passa. 100 g de uva-passa são processados adequadamente até se obterem 280 mL de solução que contêm 0,975 mg de um sal de potássio, K2A, 100% dissociado. A concentração em mol/L dos íons potássio é:
Dado: massa molar do K2A = 174 g/mol
a) 2 × 10−3 mol/L
b) 2 × 10−5 mol/L
c) 6 × 10−3 mol/L
d) 4 × 10−5 mol/L
Resolução
Primeiramente temos que converter a massa do sal em quantidade de matéria. Para isso, podemos utilizar a massa molar informada no enunciado, como mostrado a seguir:
n = m / MM
n = 9,75×10−4 g / 174 g/mol
n = 5,60×10−6 mol
Lembre-se de que: 1 mg = 1,0×10−3 g.
Agora, vamos representar a reação de dissociação do sal K2A por meio da equação química abaixo:
K2A(s) → 2 K+(aq) + A2−(aq)
A equação nos mostra que a dissociação de 1 mol de K2A produz 2 mols de íons K+, logo:
n(K+) = 2 ∙ n(K2A)
n(K+) = 2 ∙ 5,60×10−6 mol
n(K+) = 1,12×10−5 mol
A concentração em mol/L é calculada dividindo-se a quantidade de matéria do soluto pelo volume da solução em litros. Assim, temos:
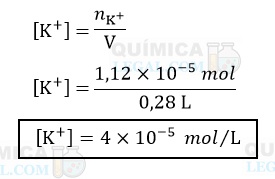
Lembre-se de que: 1 L = 1.000 mL.
Portanto, a concentração dos íons potássio, em mol/L, é igual a 4×10−5 mol/L.
Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS sobre SOLUÇÕES.
Veja também: FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da UPM?



