A equação acima representa a combustão do etanol…
C2H6O + 3 O2 → 2 CO2 + 3 H2O
A equação acima representa a combustão do etanol. Se após 2 horas de reação forem produzidos 48 mols de CO2, a quantidade em mol de etanol consumido em 1 minuto é de
a) 0,5 mol.
b) 24,0 mol.
c) 0,04 mol.
d) 0,2 mol.
e) 12,0 mol.
De acordo com a equação química, já balanceada, são produzidos 2 mols de CO2 para cada mol de C2H6O queimados. Assim, a quantidade em mols de C2H6O consumidos para produzir 48 mols de CO2 é dada por:
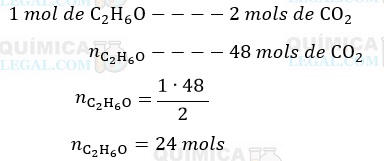
Dessa forma, após 2 horas de reação foram consumidos 24 mols de etanol. Então, considerando que a taxa de reação se manteve constante durante as 2 horas, a quantidade em mols de etanol consumida em 1 minutos é dada por:
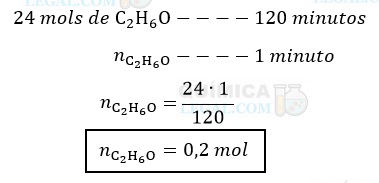
Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS do Mackenzie?


