A utilização sistemática da balança em laboratório…
(UnB-DF) A utilização sistemática da balança em laboratório, especialmente no estudo da variação de massa em reações químicas, é considerada um marco para o surgimento da Química Moderna. Um dos responsáveis por esse significativo momento da história da Química foi Antoine Laurent Lavoisier (1743-1794), cujas contribuições são até hoje utilizadas para o estudo de reações químicas, como a que é representada pela equação a seguir:
2 HCℓ(aq) + CaCO3(s) → CaCℓ2(s) + H2O(ℓ) + CO2(g)
Sabendo que M(H) = 1,0 g/mol, M(O) = 16,0 g/mol, M(Ca) = 40,0 g/mol, M(C) = 12,0 g/mol e M(Cℓ) = 35,5 g/mol, e que o grau de pureza do carbonato de cálcio é igual a 75%, determinar a massa da amostra impura de carbonato de cálcio quando são consumidos 14,6 g de ácido clorídrico.
Resolução
De acordo com a equação balanceada, 2 mols de ácido clorídrico reagem com 1 mol de carbonato de cálcio. Assim, a massa de carbonato de cálcio necessária para reagir com 14,6 g de ácido clorídrico é dada por:
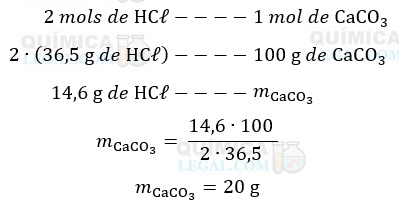
Dessa forma, são necessários 20 gramas de carbonato de cálcio para reagir completamente com o ácido clorídrico. Porém, a amostra disponível contem apenas 75% de carbonato de cálcio. Isso significa que a cada 100 g de tal amostra, 75 g é de fato carbonato de cálcio.
Assim, a massa de amostra impura necessária é dada por:

Portanto, a reação de 14,6 g de ácido clorídrico consome 26,7 g da amostra impura de carbonato de cálcio.
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Gostaria de ver mais RESOLUÇÕES COMENTADAS da UnB?



