Pesquisadores conseguiram controlar reações químicas…
Pesquisadores(…) conseguiram controlar reações químicas de um modo inovador. Usaram feixes de laser para promover um esbarrão entre dois átomos e uni‐los, criando uma molécula. Utilizando pinças ópticas (feixes de laser altamente focados capazes de aprisionar objetos microscópicos), os pesquisadores empurraram um átomo do elemento químico césio (Cs) contra um átomo de sódio (Na) até que colidissem. Um terceiro laser foi lançado sobre ambos, fornecendo energia extra para criar a molécula NaCs. Na natureza, as moléculas formam‐se a partir da interação de átomos por acaso. Por suas características químicas, césio e sódio jamais originariam uma molécula espontaneamente. (…) Molécula criada em laboratório.
Disponível em http://revistapesquisa.fapesp.br/. Adaptado.
Com base nas informações do texto e em seus conhecimentos, é correto afirmar que
a) o Cs é um elemento químico radioativo e, devido a essa característica química, a molécula de NaCs não se formaria sem esse modo inovador (L.2), que estabiliza o decaimento.
b) o raio atômico do Na é maior que o do Cs, portanto, a sua energia de ionização também é maior. O esbarrão (L.3) entre os átomos retira um elétron do Na, permitindo a ligação.
c) o terceiro laser (L.8) usado no experimento serviu para retirar um nêutron do Cs, tornando‐o um cátion e possibilitando a reação com o Na.
d) na natureza, com esses elementos se esbarrando por acaso (L.10‐11), a tendência seria formar CsNa, e não NaCs, justificando o caráter inovador do experimento.
e) o Cs e o Na não formariam uma molécula espontaneamente (L.11‐12), uma vez que ambos têm grande tendência a formarem cátions e ligações iônicas.
Resolução
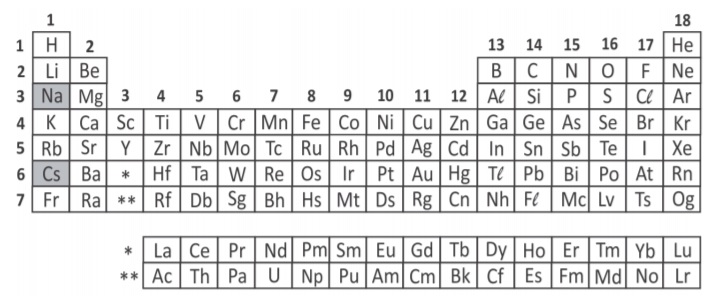
Conforme a tabela periódica, apresentada no enunciao, o césio (Cs) e o sódio (Na) são elementos do grupo 1 (metais alcalinos). E, elementos desse grupo têm a tendência de perder 1 elétron e formar cátions monovalentes (Na+ e Cs+). Assim, na natureza, fazem ligações iônicas com átomos com tendência a ganhar elétrons e formar ânions, como por exemplos os halogênios (F, Cl, Br e I).
Portanto, Cs e Na não formariam uma molécula espontânea, pois a repulsão entre seus cátions inviabiliza a formação de uma ligação iônica.
Confira mais EXERCÍCIOS RESOLVIDOS sobre CLASSIFICAÇÃO PERIÓDICA.
Gostaria de ver mais RESOLUÇÕES COMENTADAS da FUVEST?


