As máscaras de oxigênio utilizadas em aviões contêm…
(Vunesp-SP) As máscaras de oxigênio utilizadas em aviões contêm superóxido de potássio, KO2 sólido. Quando a máscara é usada, o superóxido reage com o CO2 exalado pela pessoa e libera O2, necessário à respiração, segundo a equação química balanceada:
4 KO2(s) + 2 CO2(g) → 2 K2CO3(s) + 3 O2(g)
Calcule, dado volume molar dos gases (CNTP) = 22,4 L:
a) a massa de KO2, expressa em gramas, necessária para reagir com 0,10 mol de CO2.
b) o volume de O2 liberado a 0 °C e 760 mmHg, para a reação de 0,4 mol de KO2.
Resolução
a) De acordo com a equação química, já balanceada, 2 mols de CO2 reagem 4 mols de KO2. Logo:
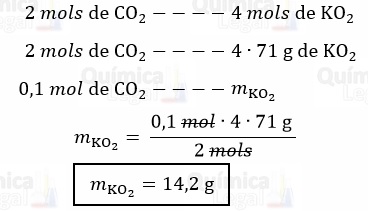
b) Como mostrado pela equação química, são produzidos 3 mols de O2 para cada 4 mols de KO2 que reagem. Além disso, sabemos que, nas condições mencionadas, 1 mol de O2 ocupa 22,4 L. Assim, temos:

Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da Vunesp?


