Em uma solução de sulfato de ferro (III) o ferro…
Em uma solução de sulfato de ferro (III) o ferro foi precipitado com amônia na forma de hidróxido de ferro (III) e calcinado. A massa do precipitado calcinado (óxido de ferro (III)) foi de 0,3288 g. Escreva as equações do processo e calcule:
a) a massa de sulfato de Fe(III) na solução
b) a massa de Fe(III) na solução.
Resolução
Reação de dissociação do sulfato de ferro (III) – Fe2(SO4)3:
Fe2(SO4)3(s) → 2 Fe3+(aq) + 3 SO42-(aq)
Reação de precipitação do ferro (III) – Fe3+:
Fe3+(aq) + 3 NH3(aq) + 3 H2O(ℓ) → Fe(OH)3(s) + 3 NH4+(aq)
Reação de calcinação do hidróxido de ferro (III) – Fe(OH)3:
2 Fe(OH)3(s) → Fe2O3(s) + 3 H2O(g)
Todas as equações químicas acima estão balanceadas.
De acordo com a última equação, a calcinação de 2 mols de Fe(OH)3 produz 1 mol de Fe2O3, ou seja, uma relação estequiométrica é de 2:1. Assim, temos:
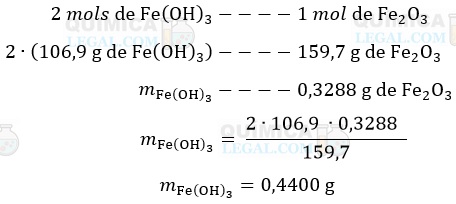
Já a segunda equação nos mostra que é formado 1 mol de Fe(OH)3 para cada mol de Fe3+ precipitado. Logo:

A primeira equação nos diz que a dissociação de um 1 mol de Fe2O3 produz 2 mols de Fe3+. Assim, temos:

Gabarito:
a) 0,2301 g
b) 0,3287 g
Confira mais EXERCÍCIOS RESOLVIDOS sobre GRAVIMETRIA.



