Entre as várias finalidades, o metal cromo é empregado…
(UFLA-MG 2008) Entre as várias finalidades, o metal cromo é empregado na produção de aço inox e na cromação de várias peças metálicas. Um processo de preparação de cromo metálico pode ser expresso pela seguinte equação:
Cr2O3(s) + 2 Aℓ(s) → 2 Cr(s) + Aℓ2O3(s)
Considerando que o rendimento da reação é de 80%, a massa de cromo produzida a partir de 10 mol de trióxido de dicromo e 600 g de alumínio é
a) 832,0 g.
b) 416,0 g.
c) 83,2 g.
d) 462,2 g.
Resolução
Primeiro temos que converter 600 g de alumínio em quantidade de matéria (n), e para isso basta multiplicar a massa deste metal pela sua massa molar, veja:
nAℓ = mAℓ / MMAℓ
nAℓ = 600 g / 27 g∙mol−1
nAℓ = 22,2 mols
De acordo com a equação química balanceada dada no enunciado, são produzidos 2 mols de cromo metálico a partir da reação de 1 mol de trióxido de dicromo e 2 mols de alumínio metálico.
Dessa forma, 10 mols de trióxido de enxofre são suficientes para produzir 20 mols de cromo metálico, enquanto 22,2 mols de Aℓ é possível produzir 22,2 mols de cromo.
Sendo assim, descobrimos que o trióxido de enxofre é o reagente limitante e, como o nome sugere, limitará a quantidade de cromo metálico produzido, logo:
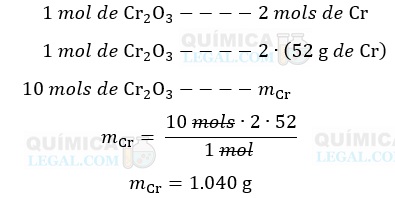
Essa seria a quantidade de cromo metálico produzida com os reagentes disponíveis. Porém, foi dito que a reação apresentou um rendimento de 80%, sendo assim a massa de cromo de fato produzida é dada por:
mCr = 1.040 g ∙ (80%/100%)
mCr = 1.040 g ∙ 0,8
mCr = 832 g
Portanto, a alternativa com a resposta correta é a letra A.
Gabarito: LETRA A
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Gostaria de ver mais RESOLUÇÕES COMENTADAS da UFLA?



