Existem dois isótopos do rubídio que…
(CESESP-PE) Existem dois isótopos do rubídio que ocorrem na natureza: 85Rb, que tem massa igual a 84,91, e 87Rb, cuja massa é 86,92. A massa atômica do rubídio é 85,47. Qual é a porcentagem do 87Rb?
a) 72,1%
b) 20,1%
c) 56,0%
d) 27,9%
e) 86,9%
Resolução
A massa atômica de um determinado elemento químico é a média ponderada das massas atômicas dos seus isótopos, os quais possuem diferentes porcentagem em massa. No caso do rubídio, que tem dois isótopos, foram informadas a massa atômica do elemento químico e as massas atômicas dos isótopos. Então, substituindo na fórmula da média ponderada temos:
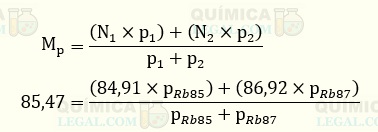
Não tem como resolver a equação acima, pois temos duas variáveis. Porém, sabemos que a soma das porcentagens em massa dos isótopos é igual a 100%. Assim, a porcentagem do 85Rb é dada por:

Substituindo a porcentagem de 85Rb na primeira equação temos:

Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS sobre CÁLCULO DE FÓRMULAS.
Veja também: EXERCÍCIOS DE QUÍMICA GERAL E INORGÂNICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS do CESESP?


