O ácido acetilsalicílico, conhecido como “aspirina”…
(Fatec-SP) O ácido acetilsalicílico, conhecido como “aspirina”, é um dos analgésicos mais consumidos. Pode ser produzido pela interação entre ácido salicílico e anidrido acético, conforme mostra a equação a seguir:
C7H6O3 + C4H6O3 → C9H8O4 + C2H4O2
ácido salicílico + anidrido acético → “aspirina”+ ácido acético
A massa de “aspirina” que seria possível produzir a partir de 1,38 tonelada métrica (1 t = 1 × 106 g) de ácido salicílico, supondo que a transformação ocorra com rendimento de 80%, é:
a) 1,10 t
b) 1,44 t
c) 180 g
d) 1,38 t
e) 7,8 g
Resolução
Segundo a equação química, já balanceada, 1 mol de ácido acetilsalicílico reage e forma 1 mol de aspirina. Assim, temos:
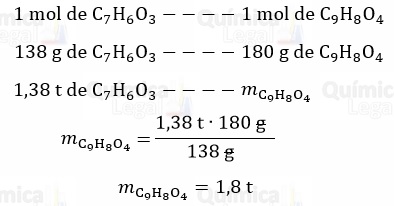
Considerando o rendimento da reação de 80%, temos:
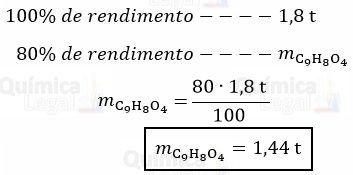
Gabarito: LETRA B
Confira mais EXERCÍCIOS RESOLVIDOS de ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da Fatec?


