Misturam-se 1,000 kg de sulfeto de carbono…
(PUC-SP) Misturam-se 1,000 kg de sulfeto de carbono, CS2, e 2,000 kg de gás cloro, Cℓ2, em um reator, onde se processa a transformação:
CS2(ℓ) + 3 Cℓ2(g) → CCℓ4(ℓ) + S2Cℓ2(ℓ)
As massas de tetracloreto de carbono, S2Cℓ2, formado e do reagente em excesso que resta quando a reação se completa são:
a) 1,446 kg de CCℓ4 e 0,286 kg de CS2.
b) 2,026 kg de CCℓ4 e 0,286 kg de CS2.
c) 1,446 kg de CCℓ4 e 0,286 kg de Cℓ2.
d) 2,026 kg de CCℓ4 e 0,286 kg de Cℓ2.
e) 1,286 kg de CCℓ4 e 0,732 kg de Cℓ2.
Resolução
Segundo a equação química, já balanceada, são necessários 3 mols de Cℓ2 para cada mol de CS2. Assim, temos:
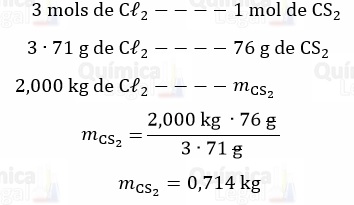
Portanto, a massa do ragente em excesso, CS2, é dada por:
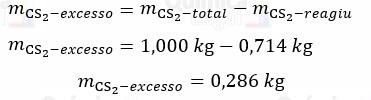
A equação química também nos mostra que a reação de 3 mols de Cℓ2 produz CCℓ4. Logo:
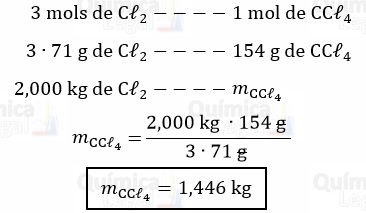
Gabarito: LETRA A
Confira mais EXERCÍCIOS RESOLVIDOS de ESTEQUIOMETRIA.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da PUC?


