Um elemento X tem massa atômica…
(CESGRANRIO-RJ) Um elemento X tem massa atômica 63,5 e apresenta os isótopos 63X e 65X. A abundância do isótopo 63 no elemento X é:
a) 25%.
b) 63%.
c) 65%.
d) 75%.
e) 80%.
Observação: considere os números de massa 63 e 65 como sendo as massas atômicas desses elementos.
Resolução
A massa atômica de um determinado elemento químico é a média ponderada das massas atômicas dos seus isótopos, que estão presente na natureza em diferentes porcentagens. A média ponderada das massas atômicas do elemento X é calculada como mostrado a seguir:
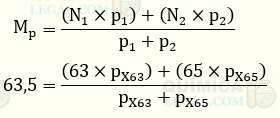
Não conseguiremos calcular o valor da porcentagem em massa do isótopo 63X, pois temos outra variável. Porém, sabemos que a soma das porcentagens em massa dos dois isótopos dever ser igual a 100%. Assim, temos:

Substituindo a porcentagem de 65X na primeira equação temos:

Portanto, a abundância do isótopo 63 no elemento X é igual a 75%.
Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS sobre CÁLCULO DE FÓRMULAS.
Veja também: EXERCÍCIOS DE QUÍMICA GERAL E INORGÂNICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS do CESGRANRIO?


