Num cristal de NaCl, a menor distância…
(ACAFE-SC) Num cristal de NaCl, a menor distância entre os núcleos dos íons Na+ e Cℓ– é 2,76 Å, e a distância entre os dois íons cloreto que se encostam é 3,62 Å.
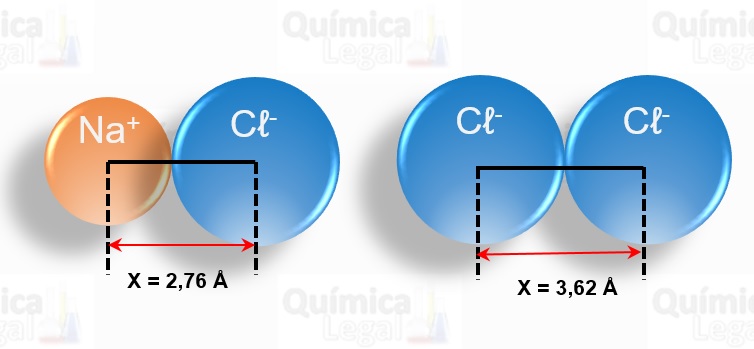
Portanto, o raio do íon sódio é:
a) 2,76 Å
b) 0,95 Å
c) 3,62 Å
d) 0,86 Å
e) 6,38 Å
Resolução
Os raios iônico e atômico são, teoricamente as distâncias entre o núcleo do átomo até o elétron mais afastado. Porém, devido a dificuldade de definir os limites da nuvem eletrônica que circunda o núcleo e acomoda os elétrons, o raio é medido a partir da distância internuclear entre dois átomos vizinhos. Em outras palavras, o raio atômico, ou raio iônico, de um elemento é a metade da distância internuclear mínima que dois átomos desse elemento podem apresentar, sem estarem ligados quimicamente.
Assim, em um cristal de cloreto de sódio o raio do íon cloreto pode ser encontrado a partir da distância entre dois íons cloreto que se encostam, e que segundo o enunciado é igual a 3,62 Å.
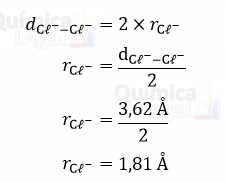
Já para encontrar o raio do íon sódio, basta subtrair o raio do íon cloreto na distância entre os íons cloreto e sódio, que, de acordo com o enunciado, é igual a 2,76 Å.
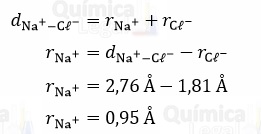
Portanto, o raio iônico do sódio é igual a 0,95 Å.
Gabarito: LETRA B
Confira mais EXERCÍCIOS RESOLVIDOS sobre LIGAÇÕES QUÍMICAS.
Tá afim de ver mais RESOLUÇÕES COMENTADAS da ACAFE?


